テルミット反応とは?
「テルミット反応の理論よりも実験方法を知りたい!」と言う方は、
こちらの記事を参考にしてください。
👉 テルミット反応の実験方法をわかりやすく解説
テルミット反応の概要
わずかな粉末を混ぜただけで、鉄が一瞬で溶け出す――。
テルミット反応とは、酸化鉄とアルミニウムの粉末を混合し、高温で着火させることで金属鉄を取り出す酸化還元反応です。
この反応では、ただ燃えるだけではありません。
金属同士が電子をやりとりし、激しいエネルギー変化を起こす本格的な酸化還元反応が進行します。
反応温度はなんと約2500℃にも達し、普通の火ではとても再現できない高温が発生します。
この強大なエネルギーを利用して、鉄道のレール溶接や金属精錬といった産業の現場でも実用されてきました。
テルミット反応は単なる実験ショーではありません。
「科学と技術が直結する、本物の現場反応」――それがテルミット反応の真の魅力です。
テルミット反応はどんな酸化還元反応なのか?
テルミット反応は、酸素と電子のやりとりが同時に起こるダイナミックな化学反応です。
ここでは、中学生でもわかりやすいように、「電子」と「酸素」の両方の視点から説明していきます。
酸化還元反応とは?【電子と酸素の2つの視点】
酸化還元反応は、物質どうしが電子をやりとりする反応です。
言い換えると、
- 酸化:電子を失うこと
- 還元:電子を受け取ること
と説明されます。
でも、これだけではちょっとイメージしにくいですよね?
実は酸化還元は、「酸素がくっつく・はなれる」でも説明できます。
- 酸化:酸素が物質にくっつく
- 還元:酸素が物質からはなれる
この「酸素のやりとり」という見方も、中学化学ではとても重要です。
テルミット反応における酸素と電子の動き
実際にテルミット反応では、酸化鉄とアルミニウムがこんなやりとりをしています。
酸化鉄(Fe₂O₃)は、持っていた酸素をアルミニウムに渡します。 → 鉄(Fe)に戻る(酸素がはなれるので還元)
アルミニウム(Al)は、酸素を受け取って酸化アルミニウム(Al₂O₃)になります。 → 酸素がくっつくので酸化
そしてこのとき、電子の受け渡しも同時に進行しているのです。
テルミット反応の化学式を確認しよう
以上のことをふまえてテルミット反応を化学式で表すと、次のようになります。
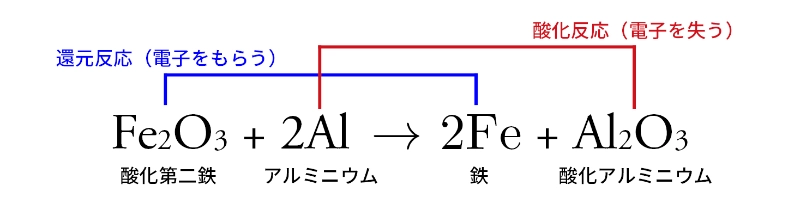
化学式から
- 酸化鉄(Fe₂O₃)が酸素を放す。(電子をもらう)
- アルミニウム(Al)が酸素を受け取る。(電子を失う)
ことが分かります。
このようにして酸化鉄から鉄を作り出しています。
酸化数の変化を見てみよう
さらに、酸化数の変化を追うと、反応のしくみがよりはっきりわかります。
| 物質 | 反応前の酸化数 | 反応後の酸化数 | 変化 |
|---|---|---|---|
| 鉄(Fe³⁺) | +3 | 0 | 還元(酸素を手放し、電子をもらう) |
| アルミニウム(Al) | 0 | +3 | 酸化(酸素を受け取り、電子を失う) |
- 鉄は+3から0に変わって還元される
- アルミニウムは0から+3に変わって酸化される
まとめ
- テルミット反応の反応温度はなんと2500℃!
- 化学式と酸化数の変化を追うと、反応のしくみがクリアに理解できる。
- 「鉄が還元」「アルミニウムが酸化」というセットで覚えると受験にも強い!
ここまでのことを踏まえて「テルミット反応の実験を行ってみたい!」と興味を持ったら、
こちらの記事を参考にしてください。
👉 テルミット反応の実験方法をわかりやすく解説
その他の記事

身近な“重曹”の正体とは?炭酸水素ナトリウムを実験で徹底解説!
重曹の正体「炭酸水素ナトリウム」をやさしく解説!加熱や酸との反応で泡が出る理由、身近な活用法まで実験付きで紹介します。

ファーレンハイト・摂氏・ケルビンを比べてみた!温度の単位のひみつを解説
「ファーレンハイト温度って何?」その疑問に答えるべく、華氏・摂氏・ケルビンの違いや由来、定義、変換式までをわかりやすく解説。温度の基準がどう決まったのかも学べます。